La química es la ciencia que estudia tanto la composición, como la estructura y las propiedades de lamateria como los cambios que esta experimenta durante las reacciones químicas y su relación con laenergía.[1] Linus Pauling la define como la ciencia que estudia lassustancias, su estructura (tipos y formas de acomodo de losátomos), sus propiedades y las reacciones que las transforman en otras sustancias en referencia con el tiempo.[2]
La química moderna se desarrolló a partir de la alquimia, una prácticaprotocientífica de carácter filosófico, que combinaba elementos de la química, lametalurgia, la física, la medicina, labiología, entre otras ciencias y artes. Esta fase termina al ocurrir la llamada Revolución de la química, basada en la ley de conservación de la materia y la teoría de lacombustión por oxígeno postuladas por el científico francés Antoine Lavoisier.[3]
- Las disciplinas de la química se agrupan según la clase de materia bajo estudio o el tipo de estudio realizado. Entre éstas se encuentran la química inorgánica, que estudia la materia inorgánica; la química orgánica, que estudia la materia orgánica; la bioquímica, que estudia las sustancias existentes en organismos biológicos; la fisicoquímica que comprende los aspectos estructurales y energéticos de sistemas químicos a escalas macroscópica, molecular y atómica, y la química analítica, que analiza muestras de materia y trata de entender su composición y estructura mediante diversos
Compuesto químico
En química, un compuesto químico es una sustancia formada por la combinación de dos o más elementos distintos de la tabla periódica.1 Los compuestos son representados por una fórmula química. Por ejemplo, el agua (H2O) está constituida por dos átomos de hidrógeno y uno de oxígeno.
Los compuestos tienen propiedades intrínsecas (ver valencia) y ciertas características como; una composición constante y componentes que siempre están en proporciones constantes. Están formados por moléculas o iones con enlaces estables que no obedece a una selección humana arbitraria. Por lo tanto, no son mezclas o aleaciones como el bronce o el chocolate.23
Finalmente, los elementos de un compuesto no se pueden dividir o separar por procesos físicos (decantación, filtración, destilación), sino solo mediante procesos químicos.
Fórmula[editar]
En química inorgánica los compuestos se representan mediante fórmulas químicas.4 El orden de los elementos en la fórmula de los compuestos inorgánicos va desde el más electronegativo a la derecha. Por ejemplo en el NaCl, el cloro que es más electronegativo que el sodio va en la parte derecha.5 Para los compuestos orgánicos existen otras varias reglas y se utilizan fórmulas esqueletales o semidesarrolladas para su representación.
Clasificación[editar]
Los principales compuestos químicos se pueden dividir en dos grandes grupos:6
- Compuestos inorgánicos:7
- Óxidos básicos. También llamados óxidos metálicos, que están formados por un metal y oxígeno. Ejemplos: el óxido plúmbico, óxido de litio.
- Óxidos ácidos. También llamados óxidos no metálicos, formados por un no metal y oxígeno. Ejemplos: óxido hipocloroso,óxido selenioso.
- Hidruros, que pueden ser tanto metálicos como no metálicos. Están compuestos por un elemento e hidrógeno. Ejemplos: hidruro de aluminio, hidruro de sodio.
- Hidrácidos, son hidruros no metálicos que, cuando se disuelven en agua, adquieren carácter ácido. Por ejemplo, el ácido iodhídrico.
- Hidróxidos, compuestos formados por la reacción entre un óxido básico y el agua, que se caracterizan por presentar el grupo oxidrilo (OH). Por ejemplo, el hidróxido de sodio, o sosa cáustica.
- Oxácidos, compuestos obtenidos por la reacción de un óxido ácido y agua. Sus moléculas están formadas por hidrógeno, un no metal y oxígeno. Por ejemplo, ácido clórico.
- Sales binarias, compuestos formados por un hidrácido más un hidróxido. Por ejemplo, el cloruro de sodio.
- Oxisales, formadas por la reacción de un oxácido y un hidróxido, como por ejemplo el hipoclorito de sodio.
- Compuestos orgánicos:8
- Compuestos alifáticos, son compuestos orgánicos constituidos por carbono e hidrógeno cuyo carácter no es aromático.
- Compuestos aromáticos, es un compuesto orgánico cíclico conjugado que posee una mayor estabilidad debido a la deslocalización electrónica en enlaces π.
- Compuestos heterocíclicos, son compuestos orgánicos cíclicos en los que al menos uno de los componentes del ciclo es de un elemento diferente al carbono.9
- Compuestos organometálicos, es un compuesto en el que los átomos de carbono forman enlaces covalentes, es decir, comparten electrones, con un átomo metálico.
- Polímeros, son macromoléculas formadas por la unión de moléculas más pequeñas llamadas monómeros
Soluto
En una disolución, el soluto es la sustancia que se disuelve, es decir, que se reparte o se dispersa en otra sustancia, que es el disolvente,12por lo que se puede encontrar en un estado de agregación diferente al comienzo del proceso de disolución y experimentar una transición de fase.
Lo más habitual es que se trate de un sólido en un disolvente líquido, lo que origina una solución líquida. Una de las características más significativas de una disolución suele ser su concentración de soluto, 4es decir la medida de la cantidad de soluto contenida en ella.
Cuando la disolución está formada por dos sustancias en el mismo estado como en una disolución líquido-líquido es difícil establecer cual es el soluto y cual el disolvente. Generalmente se acepta que el soluto es la sustancia que está en menor cantidad, siendo el disolvente la sustancia en mayor cantidad. Por ejemplo: en una disolución que contenga 5 centilitros de alcohol y 95 centilitros de agua, el alcohol sería el soluto y el agua el disolvente.1
Otra característica a considerar sería la facilidad para disolverse o solubilidad que pueda presentar en el disolvente. La solubilidad de un compuesto químico depende en gran medida de su estructura molecular. En general, los compuestos iónicos y moleculares polares son solubles en disolventes polares como el agua o el etanol;5 y los compuestos moleculares apolares en disolventes apolares como el hexano, el éter o el tetracloruro de carbono.6
Véase también[editar]
Referencias[editar]
- ↑ a b Regalado, Víctor Manuel Ramírez (2014). Química 2. Grupo Editorial Patria. ISBN 9786077440079. Consultado el 8 de noviembre de 2017.
- ↑ Canales, Margarita; Hernández, Tzasná; Meraz, Samuel; Peñalosa, Ignacio (1999). Fisicoquimica Volumen I: Teoria I. México: Universidad Nacional Autónoma de México. p. 241. ISBN 9683679579. Consultado el 1 de agosto de 2017.
- ↑ Silvestroni, Paolo (1996). Fondamenti di chimica (en italiano). Bologna : Milano: Zanichelli ; CEA. p. 229. ISBN 88-408-0998-8.
- ↑ Quiimica General. Universidad Nac. del Litoral. ISBN 9789875085961. Consultado el 8 de noviembre de 2017.
- ↑ Society, American Chemical (2005). Química: un proyecto de la American Chemical Society. Reverte. ISBN 9788429170016. Consultado el 8 de noviembre de 2017.
- ↑ Andrés, Dulce María; Antón, Juan Luis (2016). Física y Química 4º ESO (LOMCE) 2016. Editex. ISBN 9788490788028. Consultado el 8 de noviembre de 2017.
SOLUTO
Es fundamental a la hora de poder establecer el significado de la palabra soluto, que ahora a continuación vamos a analizar, el que descubramos cual es el origen etimológico de dicho concepto. Así, hay que subrayar que el mismo se encuentra en el latín, y en concreto en el vocablo solutus que puede traducirse como “disuelto, libre o liberado”.
 Una palabra latina esta que a su vez puede decirse que es el participio del verbo solvere que es sinónimo de “liberar y soltar”. No obstante, aquel también puede establecerse que tiene como significado “pagar, liberar un dinero a alguien”.
Una palabra latina esta que a su vez puede decirse que es el participio del verbo solvere que es sinónimo de “liberar y soltar”. No obstante, aquel también puede establecerse que tiene como significado “pagar, liberar un dinero a alguien”.Una solución es una mezcla con características homogéneas formada por, al menos, dos sustancias. El soluto es la sustancia que, por lo general, se encuentra en menor cantidad y que se disuelve en la mezcla. El solvente, en cambio, es la sustancia que suele aparecer en mayor cantidad y donde se disuelve el soluto.
La concentración de la solución señala la relación que existe entre la cantidad de solvente y la cantidad de soluto. Es importante destacar que las propiedades químicas del solvente y del soluto no sufren modificaciones en la solución.
El soluto suele ser un sólidoque se contiene en una solución líquida. La solubilidad está vinculada en gran parte de su polaridad. Los compuestos moleculares polares y los compuestos iónicos cuentan con la propiedad de la solubilidad en disolventes con características polares (entre los que pueden mencionarse el etanol y el H2O). Los compuestos moleculares apolares, en cambio, son solubles en disolventes apolares (como el éter).
La solubilidad está vinculada a qué tan capaz resulta una sustancia para disolverse en otra (es decir, su capacidad para actuar como soluto). Esta medida suele reflejarse en gramos por litro, moles por litro e incluso en porcentaje de soluto.
Además de todo lo expuesto tenemos que establecer que el término soluto es empleado con mucha frecuencia en materia de movimiento de agua, y en concreto en dos fenómenos que se conocen como flujo global y difusión. Así, se establece que, por ejemplo, en el primer caso que se da en seres vivos dicho flujo lo que hace es mover no sólo el agua sino también los solutos de una parte de un organismo multitucelular a otra.
Por el contrario, en lo que es la difusión los solutos, las moléculas y los iones se mueven hacia fuera, hacia dentro y a través de la propia célula.
Es importante tener en cuenta que un soluto puede ser sólido, líquido o gaseoso. El azúcar es un ejemplo de un soluto sólido que se disuelve en agua. El agua también es solvente cuando se mezcla con el etanol, que actúa como soluto líquido en este caso. Otro ejemplo de soluto que se disuelve en agua es el anhídrido carbónico, un gas que se emplea en las bebidas carbónicas. Esto muestra que los solutos pueden aparecer en cualquier estado de agregación de la materia
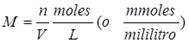
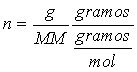
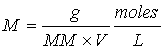
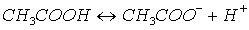
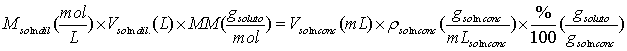
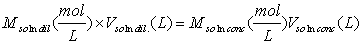
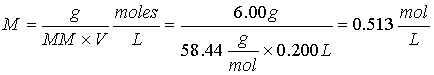
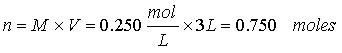
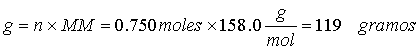
Esta unidad de concentración se basa en el volumen de una solución y por ello es conveniente utilizarla en los procedimientos del laboratorio en donde la cantidad medida es el volumen de solución. La molaridad se define como el número de moles de soluto por litro de solución (también como el número de milimoles de soluto por mililitro de solución):
en donde M es la molaridad, n es el número de moles de soluto y V es el volumen de solución expresado en litros. Ya que:
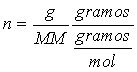
en donde g representa los gramos de soluto y MM la masa molecular del soluto, de aquí que:
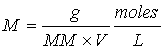
Cuando se da la información de la concentración de una especie química en moles por litro esto se indica poniendo la fórmula de la especie dada entre corchetes. Por ejemplo, [H+] = 0.1 nos indica que la concentración de H+ es de 0.1 moles/litro.
Tratándose del equilibrio químico, es necesario distinguir entre la concentración analítica que no es más que el número total de moles de un soluto en un litro de solución y la molaridad analítica de una especie en equilibrio. Por ejemplo, si añadimos 0.1 moles de ácido acético a un litro de agua, tendremos una concentración analítica de ácido acético 0.1 molar. Sin embargo en virtud del equilibrio:
una fracción de las moléculas de ácido acético estará ionizada por lo que la concentración real de la especie CH3COOH será menor que 0.1 molar.
Algunos reactivos de mucha aplicación en análisis químico son manufacturados en estado líquido como una disolución concentrada de la sustancia de interés. Entre estas sustancias tenemos la mayoría de los ácidos que con mayor frecuencia se utilizan en los laboratorios como son el ácido sulfúrico, clorhídrico, etc. En los frascos de estos ácidos concentrados nos indican los fabricantes su porcentaje (% masa/masa) y densidad de la solución del ácido. Con estos datos podemos calcular el volumen necesario del ácido concentrado para preparar un ácido más diluido. Para ello nos basamos en la masa de reactivo necesaria para preparar la solución es igual a la masa que encontramos de ese reactivo en una solución concentrada. Por ejemplo para una solución diluida cuya concentración se da en forma de molaridad:
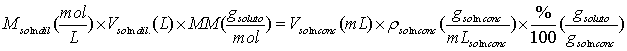
En general la ley de conservación de la masa, en este caso particular aplicada a las soluciones, nos exige que el número de moles al preparar una dilución de una solución se mantenga constante y esto se expresa por:
Ejemplos de cálculos relacionados con la molaridad.
Ejercicio 1. Calcule la molaridad de una solución que contiene 6.00 g de NaCl (MM 58.44) en 200 ml de solución.
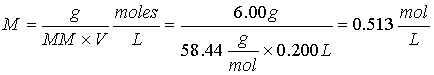
Ejercicio 2. Calcule el número de moles y el número de gramos de KMnO4 (MM 158.0) en 3.00 litros de una solución 0.250 M.
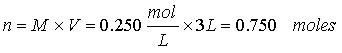
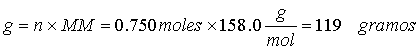



No hay comentarios:
Publicar un comentario